Un viaggio nel blu

Dall'Egitto dei Faraoni all'Oregon Ste University ... ed oltre
Il colore blu è abbondantemente presente nel mondo intorno a noi nelle sue varie tonalità. Di questo colore ci appaiono il cielo, il mare e gli altri specchi d’acqua. Nell’arte figurativa il colore blu è utilizzato per rappresentare la realtà che ci circonda. In molte religioni, poiché il blu è il colore del cielo e dell’acqua, è collegato all’idea del divino.
 |
 |
 |
Tuttavia, a differenza di altri colori come il giallo, il rosso, il verde o il marrone per i quali si trovano facilmente materiali comuni come le terre in grado di restituirne diverse tonalità, la natura offre pochi materiali in grado di fornire i pigmenti adatti per riprodurre su una tela o in un affresco il blu.
 |
 |
E pochi i vegetali idonei, tra i quali l’Indigofera tinctoria e la Isatis tinctoria da cui si estrae il colorante chiamato indaco.
 |
 |
| Indigofera tinctoria | Isatis tinctoria |
Nel corso dei secoli si è assistito alla messa a punto di procedure empiriche per la preparazione di questi pigmenti. In tempi più vicini a noi, con la nascita e lo sviluppo della chimica, si è riusciti a sintetizzare nuovi composti in grado di aggiungersi a quelli naturali e di ampliare così il numero di prodotti utilizzabili.
Con questo documento vogliamo compiere un viaggio sui più interessanti pigmenti blu mettendo in luce il ruolo dei chimici nella loro preparazione e nella loro sintesi, con uno sguardo finale rivolto al futuro, che prende esempio da insospettabili fenomeni naturali.
IL BLU EGIZIANO
Il pigmento, generalmente conosciuto col nome di 'blu egiziano’, è considerato tra i primi prodotti artificiali nella storia delle produzioni artigianali. Questo non veniva ricavato direttamente da sostanze naturali, come accadeva per altri pigmenti, ma da un processo di cottura di diversi ingredienti. A temperature di 900-1000°C si riscaldava per molte ore una miscela di silice, rocce calcaree, minerali contenenti rame e carbonato di sodio.
Se tra i minerali contenenti rame veniva utilizzata la malachite, la reazione che avveniva era la seguente:
Cu2CO3(OH)2 + 8 SiO2 + 2 CaCO3 → 2 CaCuSi4O10 + 3 CO2 + H2O
 |
 |
 |
| Malachite | Calcite | Quarzo |
Si otteneva un conglomerato solido, chiamato «fritta egizia», costituita da cristalli blu con la stessa composizione di un minerale raro come la cuprorivaite CaCuSi4O10 , insieme a cristalli di quarzo e vetro. La cuprorivaite veniva poi finemente sminuzzata ottenendo così una polvere che veniva utilizzata come tinta pittorica. La cuprorivaite poteva anche essere nuovamente impastata per la fabbricazione di vasi e piccole statue.
 |
 |
 |
Nell’antichità il Blu Egiziano era diffuso in tutto il bacino del Mediterraneo e nel Vicino Oriente. Oltre che in Egitto esso era presente in Mesopotamia, in Grecia e a Roma dove costituì il pigmento blu di più largo impiego. Testimonianze del suo impiego si trovano anche nel Nordeuropa romano e sassone (Germania, Gran Bretagna) grazie anche a una produzione locale, e addirittura fino in Norvegia. Lo ritroviamo anche negli affreschi che decoravano molte ville di Pompei.
 |
Nel De Architectura di Vitruvio, I secolo a. C., troviamo la descrizione di una possibile preparazione del Blu Egiziano. E’ di alcuni mesi fa la notizia apparsa sulla stampa dell’uso di questo pigmento da parte di Raffaello nel Trionfo di Galatea, opera conservata a Villa Farnesina a Roma. Si ritiene che il pittore di Urbino abbia preparato il pigmento proprio a partire dalla ricetta presente nel De Architectura di Vitruvio. Questo è stato verificato con lo studio delle caratteristiche proprietà di luminescenza del pigmento che può essere rivelata attrasverso un'indagine RIL - imaging (Red Induced Luminescence).
 |
 |
| Confronto tra l'immagine visibile (sinistra) e quella ottenuta da RIL-imaging (destra), che mette in evidenza la distribuzione del pigmento nel cielo e negli occhi di Galatea. |
L’utilizzo di questo pigmento venne meno con la caduta dell’Impero Romano, anche se studi recenti ne hanno rilevato la presenza in opere pittoriche di età successiva, risalenti al Medioevo ed anche al Rinascimento.
Il blu oltremare
Gli artisti che dal XIV secolo in poi utilizzarono il blu nelle loro opere si servirono dell’oltremare naturale. Questo pigmento deriva dall’utilizzo del lapislazzuli. Il lapislazzuli è una roccia costituita prevalentemente da lazurite Na3Ca(Al3Si3O12)S, alcune specie appartenenti al gruppo della sodalite ed altri minerali in minori quantità, come la calcite e la pirite. E’ da rimarcare come, a differenza di altri pigmenti, il colore azzurro non dipenda dalla presenza di ioni cobalto o rame, ma bensì dalla presenza nel reticolo cristallino di ioni polisolfuro.
 |
 |
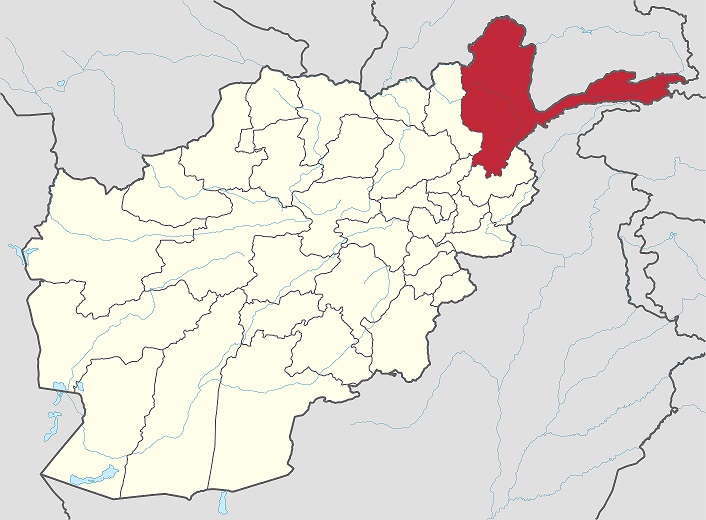
Fin dall’antichità le antiche cave di Badakshan (nell’attuale Afghanistan) costituirono la principale fonte del prezioso minerale, il cui nome deriva probabilmente dal fatto che per giungere fino a noi doveva attraversare il Mar Mediterraneo.
Le cave furono descritte da Marco Polo, che indicò come il minerale venisse utilizzato già ai suoi tempi per l'estrazione di un pigmento blu. Per molti secoli il Badakshan fornì praticamente tutto il lapislazzuli utilizzato in Europa. Il minerale arrivava probabilmente nel nostro continente prevalentemente attraverso il porto di Venezia, principale approdo per le merci provenienti dall’Oriente.
|
|
La macinatura e il lavaggio del minerale davano però in genere solo una polvere blu-grigiastra priva di purezza e profondità di colore. Dal XIII secolo pero’ si perfezionarono nuove metodologie come quella descritta nel Libro dell’Arte scritto all’inizio del XV secolo da Cennino Cennini (1370-1427) che lo definì “colore nobile, bello, perfettissimo oltre a tutti i colori”. Il minerale macinato veniva impastato con una miscela di cera fusa e resine. Il tutto era avvolto in un panno, imbevuto con una soluzione diluita di liscivia (una soluzione di carbonato preparata estraendo ceneri di legno con acqua). Le particelle blu di lazurite venivano lavate via da questo processo e si depositavano sul fondo del vaso. Le particelle blu più grandi e colorate si depositavano per prime. Di solito si effettuavano almeno tre estrazioni separate, raccogliendo così diversi pigmenti di qualità decrescente.
L'alto costo della materia prima e il lungo e laborioso processo di estrazione rendevano il blu oltremare di buona qualità molto costoso. Nel tardo Medioevo questo pigmento veniva utilizzato per dipingere le pale d’altare e gli affreschi, come in quest’opera di Masaccio «Madonna in trono con Bambino e quattro angeli».
Con l’affermarsi della pittura ad olio gli artisti iniziarono a mescolare il blu oltremare con altri colori, aumentando così la gamma cromatica dell’azzurro, conferendogli maggiore luminosità, come nella Madonna Aldobrandini di Tiziano
 |
 |
Azzurrite
L’impiego dell’oltremare per molti decenni fu limitato all’Italia, soprattutto per motivi commerciali, in quanto i suoi porti erano i canali tramite i quali il pigmento giungeva in Occidente. Un’alternativa sempre abbastanza costosa, ma tuttavia un poco più economica rispetto al blu oltremare, fu, per gli artisti di tutti i paesi, l’uso dell’azzurrite
2CuCO3∙Cu(OH)2
L’azzurrite è un carbonato basico di rame, la cui preparazione avveniva macinando il materiale in grani di dimensioni opportune che ne garantivano una colorazione ed una capacità coprente ottimale. Un macinato troppo fine infatti, risultava in colorazioni chiare che potevano poi evolvere in tonalità verdi, mentre nel caso di una polvere più grossolana si aveva l’ottenimento di un colore scuro, difficile da stendere. Chimicamente questo minerale è instabile e molto reattivo. A contatto con fonti di calore può facilmente trasformarsi in ossido di rame nero (CuO), rilasciando anidride carbonica. Per tale motivo l’azzurrite non è adatta all’affresco. Il pigmento può alterarsi verso il nero anche venendo a contatto con solfuri presenti in altri pigmenti, dando luogo a solfuri di rame, come si nota ad esempio nel dipinto di Raffaello "Madonna e Bambino in trono con Santi".
 |
 |
In ambienti umidi può trasformarsi inoltre in malachite, minerale di colore verde, al quale spesso l’azzurrite è associato. Dal punto di vista chimico la reazione è:
2{2CuCO3∙Cu(OH)2}+ H2O → 3{CuCO3∙Cu(OH)2} + CO2
Azzurrite Malachite
Una volta scoperti e sintetizzati pigmenti più economici e più stabili, l’uso di questo pigmento è stato ad un certo punto abbandonato.
Blu Maya
Nel centro America, tra i primi secoli dopo Cristo fino agli inizi della colonizzazione spagnola, fu utilizzato un pigmento blu che ritroviamo ancor oggi nella decorazione di vasi e statue e nella pittura murale, lasciateci dalla civiltà Maya.
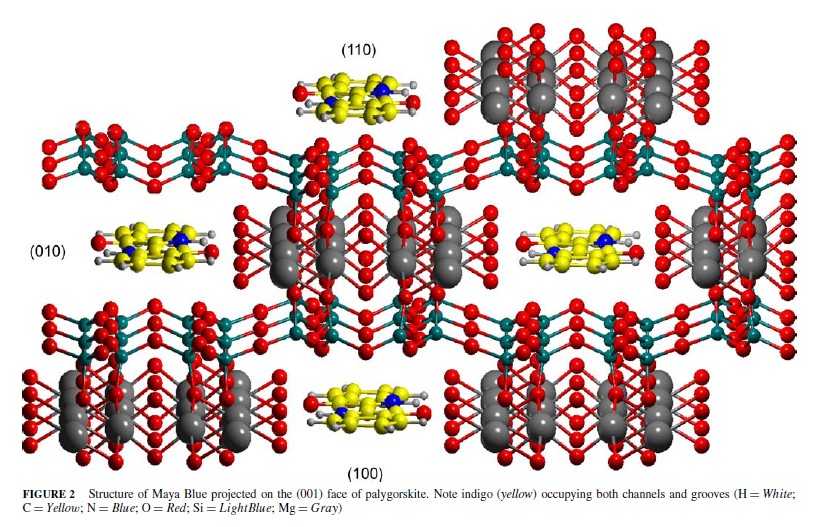
Come hanno mostrato indagini scientifiche della seconda metà del XX secolo, questo pigmento, chiamato blu Maya, veniva ottenuto scaldando a temperature intorno ai 150-200 °C un miscuglio di foglie di piante contenenti indaco e una particolare argilla porosa, detta Palygorskite.
Questa argilla ha una struttura costituita da lunghi canali interni, che le consente di assorbire e trattenere quantità abbastanza elevate di colorante.
Qualcuno ha definito il blu Maya un precursore dei moderni materiali nanocompositi di tipo supramolecolare, in cui un ospite organico, l'indaco, è incorporato in una struttura porosa inorganica, fornendo un pigmento stabile e durevole.
 |
Smaltino
Torniamo ora nell’Europa del Rinascimento e ai problemi che i pittori incontravano nell’utilizzare pigmenti blu a causa del loro elevato costo e della loro scarsa reperibilità. Una soluzione non del tutto soddisfacente in quei secoli fu costituita dallo smaltino. Lo smaltino era prodotto mescolando accuratamente ossido di cobalto con il vetro fuso. Una volta ben amalgamato, al vetro era aggiunta acqua. Lo shock termico faceva frantumare il materiale in piccoli frammenti che venivano successivamente macinati per produrre il pigmento. Essendo un vetro, lo smaltino è trasparente ed il suo colore non è mai intenso, anche se questo può variare a seconda della quantità di cobalto presente.
Il pigmento però presentava alcuni problemi. Il principale era una alterazione della sua colorazione che passava da una tonalità azzurra ad una tonalità quasi rosa, che finivano per dare una colorazione tendente al grigio, come nella parete di fondo del dipinto di J. Vermeer Due gentiluomini e una fanciulla con bicchiere di vino. E’ stato dimostrato come questo sia dovuto ad un cambiamento della geometria di coordinazione degli atomi di ossigeno allo ione cobalto.
 |
 |
Indaco
L’indaco è una sostanza organica che viene estratta sin dall’antichità dalle foglie di alcune piante appartenenti per lo più alla famiglia delle leguminose, come l’Indigofera tinctoria, originaria dell’India, ma diffusa in molti Paesi caratterizzati da clima tropicale. In Europa l’indaco fu estratto per molti secoli dall’Isatis tinctoria, comunemente conosciuta con il nome di guado
 |
 |
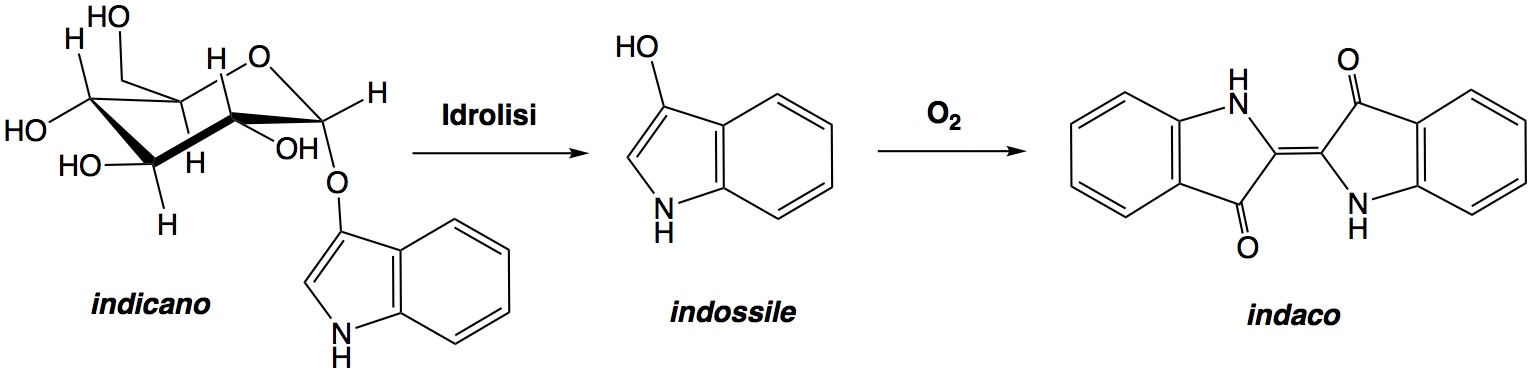
Per ricavare l’indaco prima si procedeva alla macinazione delle foglie e poi alla macerazione delle stesse. Dopo queste due procedure l’indicano presente nelle foglie perde la molecola di glucosio trasformandosi in un prodotto intermedio (indossile). Infine, grazie all’ossigeno dell’aria, si arriva alla formazione dell’indaco, la cui intensa colorazione è dovuta alla estesa delocalizzazione degli elettroni sulla molecola.
Essendo l’indaco insolubile in acqua precipita sotto forma di una sorta di fango di colore blu.
 |
L’importanza dell’indaco è fortemente legata alla sua efficacia come colorante di vari tipi di tessuti: lino, cotone, lana.
Caratteristico è il colore che fornisce ai blue-jeans . Per essere utilizzato come colorante deve per essere reso solubile e in grado quindi di impregnare le fibre tessili. Questo viene ottenuto tramite riduzione a leuco-indaco incolore. Questo si lega alle fibre del tessuto e poi viene riportato ad indaco azzurro grazie all’azione dell’ossigeno atmosferico.
 |
 |
Come pigmento nella pittura l’indaco venne utilizzato soprattutto nei secoli XVI e XVII. A partire dalla seconda metà dell’Ottocento svolse un ruolo fondamentale nell’industria tessile come colorante, ma più in generale crebbe il suo utilizzo in ambito industriale grazie alla determinazione della sua struttura molecolare e alla messa a punto di procedure per la sua sintesi chimica. Furono operazioni fondamentali portate avanti da numerosi chimici, tra i quali va ricordato Adolph von Baeyer, insignito del premio Nobel per la chimica nel 1905 «per i servizi resi allo sviluppo della chimica organica e dell’industria chimica attraverso il suo lavoro sui coloranti organici». All'epoca la produzione di indaco naturale era di 19.000 tonnellate. Il più economico indaco sintetico sostituì rapidamente l'indaco naturale per la tintura industriale e nel 1914 la produzione di indaco naturale scese a 1.000 tonnellate. Dati del 2010 ne indicano una produzione industriale di circa 80.000 tonnellate.
 |
Sin dalla fine del XIX secolo, la chimica delle sostanze coloranti era predominio dell’industria tedesca, grazie alla sua superiorità tecnico-scientifica e dalla concentrazione del potere economico. Le principali industrie tedesche, tra cui la Basf, la Bayer e la Hoechst, nel 1925 avevano dato vita infatti alla IG Farbenindustrie che deteneva il monopolio della produzione di una grande varietà di composti chimici di base e loro derivati.
 |
Nonostante il predominio tedesco, l’industria dei coloranti in Italia conobbe un periodo di intenso sviluppo dagli albori del XX secolo, con l’attività dell’ACNA di Cengio in provincia di Savona, sulle sponde del fiume Bormida, che dà il nome all’omonima valle. L’ACNA, inizialmente Aziende Chimiche Nazionali Associate fu istituita nel 1928 in seguito alla riconversione della SIPE, Società Italiana Prodotti Esplodenti, nata nel 1891 dall’antico dinamitificio Barbieri (1882). Inizialmente la produzione di intermedi di sintesi e di coloranti, che si attestava al sesto posto a livello mondiale, fu comunque accompagnata ancora dalla fabbricazione di prodotti per l’industria bellica, preparati a partire dalle stesse materie prime e analoghi passaggi sintetici.
In seguito all’acquisizione nel 1931 da parte della Montecatini e della tedesca IG Farben, la sua denominazione cambiò in Aziende Colori Nazionali e Affini. Questa operazione congiunta ebbe come scopo non solo lo sviluppo di una industria carbochimica integrata in Italia (coloranti, intermedi di sintesi, concimi e gas ricavati dal catrame di carbone), ma anche il blocco dell’avanzata dell’americana Dupont sul mercato europeo.
A partire dal periodo della seconda guerra mondiale, per l’ACNA iniziò un inesorabile declino. La produzione subì infatti una forte riduzione a causa della difficoltà di approvvigionamento di carbone, fino a perdere la sua centralità con la vittoria degli alleati e il successivo passaggio dalla chimica del carbone alla chimica basata sul petrolio.
Ulteriori vicissitudini derivate da acquisizioni da parte di altre aziende e delocalizzazioni della produzione, e non ultimo il drammatico impatto sull’ambiente e sulla salute dei lavoratori causato negli anni, portarono nel gennaio del 1999 alla definitiva chiusura dell’impianto.
 |
Una importante testimonianza dei prodotti dell’ACNA, dei quali sono riportate alcune immagini, è conservata nel nostro Museo.
 |
 |
Il blu di Prussia
Il blu di Prussia - nome IUPAC Ferro (II, III) esacianoferrato (II, III), formula chimica FeIII4 [FeII (CN)6]3 – fu ottenuto in maniera abbastanza empirica e casuale agli inizi del ‘700, in un’epoca ben lontana dalla chimica modernamente intesa, senza alcun legame con le nostre attuali conoscenze di composizione elementare, formula, tipo di legami, struttura.
La prima scoperta del blu di Prussia avvenne nel 1707 a Berlino nel laboratorio di Johann Konrad Dippel, studioso di teologia e alchimista, che in quel momento era impegnato nella preparazione del cosiddetto ‘olio animale’, da lui ritenuto una sorta di medicina universale. La preparazione consisteva nella distillazione di sangue animale col ‘sale tartari’, in termini moderni carbonato di potassio.
Lavorava nello stesso laboratorio alchemico un certo Diesbach, che si stava occupando della produzione di colori. Per la preparazione di un pigmento rosso Diesbach partiva da una soluzione ottenuta estraendo dalle cocciniglie il colorante naturale con acqua bollente. Poi si aggiungeva solfato ferroso, allume e carbonato di potassio. La scoperta casuale del blu di Prussia nacque proprio dal fatto che Diesbach utilizzò il carbonato di potassio contaminato da sangue animale, notoriamente ricco di ioni ferro, ottenendo non il previsto colorante rosso intenso, ma un precipitato blu.
Questa importante scoperta casuale fornì all’arte un pigmento blu nuovo, più stabile dell’azzurrite e dello smaltino e più economico del blu oltremare.
Nel tempo il blu di Prussia è stato preparato in molte altre maniere ed è stato usato largamente in molti altri settori e non solo come pigmento blu.
Dal Settecento in poi ha trovato largo uso presso molti pittori provenienti da ogni parte del mondo. Tra i tantissimi ricordiamo il pittore ed incisore giapponese Katsushika Hokusai.
 |
Il Blu coblato
Tra il XIX e XX secolo, grazie al contributo di A. L. Lavoisier e di altri scienziati, nacque la chimica moderna, che fornì da subito un contributo decisivo alla ricerca di nuovi pigmenti blu che compensassero la scarsità naturale di prodotti idonei.
Uno dei primi chimici che affrontò il problema fu il francese Louis Jacques Thénard. In un articolo del 1804 egli pubblicò i risultati delle sue ricerche che gli erano state commissionate da Jean Antoine Chaptal, Ministro dell’Interno di Napoleone e lui stesso chimico.
 |
 |
Il pigmento blu all’epoca disponibile era il blu di Prussia che aveva molte qualità, ma mancava di quella che Thénard definiva solidità: un cielo azzurro dopo qualche tempo perdeva il suo splendore e tendeva a diventare verde. Il nuovo pigmento venne messo a punto da Thénard a partire dalla osservazione della bellezza e dalla conservazione nel tempo del blu dei vasi di Sèvres per il quale veniva utilizzato l’arseniato di cobalto.
Egli pensò che se avesse mescolato questo sale all’allumina, avrebbe potuto ottenere un risultato simile anche in un pigmento.
Questo lo portò a fare diversi esperimenti come scaldare a temperature differenti miscele in vari rapporti dei due sali giungendo a trovare il rapporto e la temperatura ottimali per ottenere il nuovo pigmento che egli testò con successo esponendolo a luce prolungata e all’azione di acidi ed alcali, senza che il pigmento perdesse le sue qualità cromatiche.
L’uso del nuovo blu, chiamato blu cobalto, si diffuse largamente tra i pittori. Vincent van Gogh ne fece largo uso in molti suoi capolavori come il famosissimo Notte Stellata.
 |
 |
Oltremare artificiale
La sintesi dell’oltremare avvenne grazie al contributo di diversi chimici prevalentemente francesi nei primi anni del XIX secolo. Il percorso inizia dalla determinazione della composizione dell’oltremare naturale pubblicata nel 1806 da Charles-Bernard Desormes et Nicolas Clément. Sull’oltremare naturale purificato i due francesi avevano effettuato prove chimiche e fisiche fino a determinarne la composizione. Essi stabilirono che gli elementi costituenti erano sodio, alluminio, silicio, ossigeno e zolfo, escludendo la presenza di ferro.
Un passo avanti sulla strada della sintesi di un’oltremare artificiale fu la presenza di depositi vetrosi bluastri sulle pareti delle fornaci dove si produceva calce o soda. Così venne richiesta a Louis-Nicolas Vauquelin, professore di Chimica alla Facoltà di Medicina di Parigi, l’analisi di questi prodotti. La composizione di questi materiali e la loro reattività chimica, apparvero a Vauquelin non molto diverse da quelle dell’oltremare naturale e questo faceva sperare che forse si sarebbe potuta in un futuro imitare la natura e sintetizzare il prezioso pigmento. A partire da queste premesse la Societé d'Encouragement pour l'Industrie Nationale nel 1824 offrì un premio di 6000 franchi a chi avesse messo a punto un metodo per la preparazione di un oltremare artificiale che potesse essere preparato con una spesa di 300 franchi al chilo.
Nel 1828 il premio venne assegnato a Jean Baptiste Guimet «per la individuazione di un procedimento economico, grazie al quale si possa preparare un oltremare di qualità analoga da quello che si ottiene dalla lazurite». Questi, figlio di un ingegnere, aveva studiato chimica dal 1813 al 1816 al Politecnico di Parigi. Nel 1824 aveva sposato Marguerite Rosalie (detta Zelia) Bidauld, figlia del pittore Jean-Pierre-Xavier Bidauld e pittrice anch’essa. Fu questa probabilmente la motivazione che spinse Guimet a studiare la possibilità di ottenere per sintesi l’oltremare.
 |
Già nel 1826 egli ottenne alcuni primi risultati. Il procedimento da lui messo a punto consisteva nel miscelare caolinite Al2Si2O5(OH)4, carbonato di sodio (Na2CO3), zolfo (S), solfato di sodio Na2SO4 e un agente riducente, il carbone (C), in un recipiente di terracotta. Il tutto veniva scaldato gradualmente in un forno fino a 800 °C. Dopo aver mantenuto il tutto per giorni a questa temperatura, seguiva un lento raffreddamento. L’intero processo durava all’incirca un mese. Il prodotto ottenuto veniva poi macinato, lavato, decantato ed asciugato.
Prima ancora di comunicare ufficialmente i risultati ottenuti, probabilmente grazie anche alle relazioni che la moglie aveva con l’ambiente artistico, egli ebbe la possibilità di far testare ad alcuni pittori il proprio pigmento blu.
Nel 1827 questo fu utilizzato con ottimi risultati e piena soddisfazione dell’artista in uno dei principali personaggi del dipinto “L’apoteosi di Omero” di Jean-Auguste-Dominique Ingres.
 |
Nel 1828 Guimet comunicò alla Societé d'Encouragement pour l'Industrie Nationale quanto ottenuto e gli venne consegnato il premio che era stato fissato. Nella relazione con cui la Società comunicò l’assegnazione, si affermava: “Questa scoperta farà epoca nella storia della pittura; è una di quelle di cui le arti chimiche possono più giustamente vantarsi”.
Il prezzo iniziale del pigmento sintetizzato da Guimet era più alto di quello che nel premio era stato indicato ma rapidamente nei mesi successivi un affinamento del metodo portò ad un ulteriore abbassamento dei costi. Questo gli consentì alcuni anni dopo di impiantare una fabbrica nei pressi di Lione per produrre il pigmento in grande quantità ed a costi così bassi da poter competere col blu di cobalto sintetizzato da Thénard e sostituirlo quindi come materiale sbiancante nella fabbricazione della carta e dei tessuti.
A tale proposito dobbiamo sottolineare, come, a partire dall’inizio della rivoluzione industriale, la ricerca sui pigmenti ed in genere sulle sostanze colorate non abbia avuto come obiettivo solo il loro uso da parte degli artisti, ma, in maniera sempre più crescente, la loro applicazione per la colorazione di materiali quali tessuti, cementi, plastiche.
 |