Usi dell'acido solforico
Fabbricazione dell'acido nitrico
L'acido nitrico era ottenuto dal salnitro (nitrato di potassio) per reazione con acido solforico e successiva distillazione. La distillazione poteva essere effettuata in storte di vetro per ottenere elevate purezze, o in cilindri di ghisa.
La miscela di reazione, nitrato di potassio e acido solforico, era introdotta attraverso la tramoggia (T) nei cilindri di ghisa (A) scaldati dalla fornace (F).
I vapori di acido nitrico che si sviluppavano erano condensati in una serie di brocche (C).
L'acido delle prime brocche era impuro di acido solforico ed ipoazotide. Se si desiderava acido nitrico diluito si caricavano le brocche con una quantità calcolata di acqua.
Processi moderni: acido nitrico
L'acido nitrico già nell'ottocento era divenuto un reattivo di primaria importanza. L'industria dei coloranti, il primo comparto dell'industria dei composti organici, dipendeva totalmente dall'approvvigionamento di questo reattivo. Erano già noti la nitroglicerina e la nitrocellulosa, il potere fertilizzante del nitrato di ammonio e quello esplodente del tritolo e dell'acido picrico.
In altre parole l'acido nitrico aveva potenziali usi civili e militari molto più estesi di quelli consentiti dagli approvvigionamenti dei nitrati naturali (guano ad esempio), non sempre facilmente accessibili, specie in tempo di guerra. Già nel 1903 avevano avuto successo, in Norvegia, i primi tentativi di preparare industrialmente l'acido nitrico facendo scoccare la scintilla elettrica in un'atmosfera di azoto ed ossigeno.
In Germania, in Inghilterra, negli Stati Uniti ed in Francia, paesi in cui l'energia elettrica aveva costi ben più alti che in Norvegia, furono battute altre strade che partivano dall'ossidazione con ossigeno atmosferico dell'ammoniaca, di cui, intanto (1913) era stata messa a punto la sintesi a partire dall'azoto atmosferico.
Il metodo, ancora in uso, è di estrema semplicità e consiste nel far passare una miscela di ammoniaca ed ossigeno a 900 °C su un catalizzatore di platino. Avvengono le reazioni:
4NH3 + 5O2 → 4NO + 6H2O
2NO + O2 → 2NO2
3NO2 + H2O → 2HNO3 + NO
Fabbricazione della soda
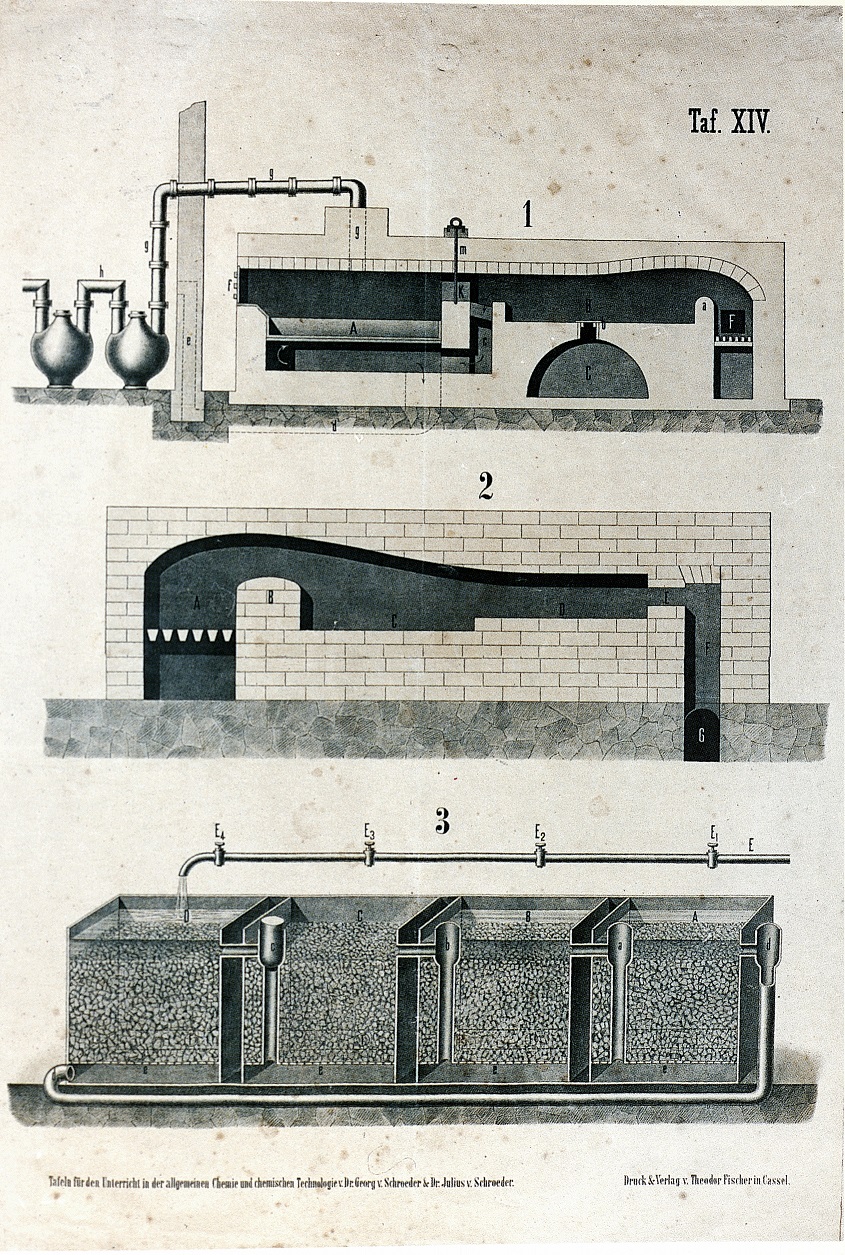
La tav. XIV illustra l'impianto Leblanc per la produzione di carbonato di sodio (Na2CO3). Il processo comportava le reazioni:
2NaCl + H2SO4 → 2HCl + Na2SO4 che avveniva nel forno 1.
Na2SO4 + 2C → Na2S + 2CO2 ; Na2S + CaCO3 → CaS + Na2CO3 che avvenivano nel forno 2.
La miscela dei composti di partenza iniziava a reagire nella capsula di piombo (A) (fig. 1), scaldata dai gas provenienti dalla fornace (F); quindi, ancora fluida, veniva trasferita in (B), dove, a temperature più elevate, la reazione si completava. L'acido cloridrico era convogliato attraverso i condotti (g) agli impianti di recupero (vedi anche Tav XV).
Il solfato sodico raccolto in (C) (fig. 1) miscelato con carbone e carbonato di calcio era avviato ai forni a riverbero (fig. 2), dapprima nella camera D di preriscaldamento, e quindi nella camera di fusione (C). La miscela di reazione, dopo raffreddamento, era frantumata e trasferita nell'impianto di lisciviazione (fig. 3) dove, mediante lento lavaggio con acqua, il carbonato sodico ed il solfuro di calcio avendo differenti solubilità, potevano essere separati l'uno dall'altro. In fig. 3 è il cassone (C), quello che per ultimo è stato caricato con i prodotti di reazione provenienti dal forno 2. La sua comunicazione con il cassone (D) è chiusa, e l'acqua di lisciviazione immessa in (D) arriva in (C) dopo essere passata nei cassoni (A) e (B) attraverso il condotto (d) ed i sifoni (a) e (b). I cassoni (D), (A) e (B) avevano ricevuto in precedenza, e in questo caso ordine, le loro cariche .In tal modo, manovrando i rubinetti dell'acqua E1 - E4 ed i sifoni (a), (b), (c) e (d), ciascun cassone, a turno, funziona come primo, secondo, ecc. L'acqua di lisciviazione li percorre nello stesso ordine, estraendo da cassoni sempre più ricchi del composto più solubile.
Processi moderni: carbonato sodico
Il carbonato di sodio non si prepara più con il metodo Leblanc. Questo metodo ha una triste storia di inquinamento e di malattie professionali.
Le cronache inglesi di metà ottocento riferiscono di campagne devastate e di lavoratori che, a quaranta anni, avevano bronchi, polmoni pelle e dentatura rovinati dai fumi di acido cloridrico.
Per questo composto, a quel tempo, non esistevano grandi sbocchi commerciali e non fu conveniente recuperarlo finché l'industria tessile non cominciò a d usare l'ipoclorito di calcio come sbiancante. A quel punto l'acido cloridrico cessò di essere un prodotto indesiderato del processo Leblanc e divenne un intermedio per la preparazione del cloro e dell'ipoclorito. Nel 1863 era stato proposto il processo Solvay come alternativa per la preparazione del carbonato di sodio, ma passarono altri vent'anni prima che il processo si affermasse, fra mille difficoltà, contro la lobby del processo Leblanc. La contesa fra i due metodi fu definitivamente risolta da un nuovo avanzamento tecnologico: l'uso dei processi elettrochimici per prepara il cloro e l'idrossido di sodio a costi molto minori del processo Leblanc. Tutto il carbonato di sodio attualmente in commercio è prodotto con il metodo Solvay, che si basa sulle seguenti reazioni.
NaCl + NH3 + CO2 + H2O → NH4Cl + NaHCO3
2NaHCO3 → Na2CO3 + CO2 + H2O
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
Il bicarbonato di sodio (NaHCO3) è il composto meno solubile fra quelli che si formano nella prima reazione, e pertanto precipita e viene filtrato. Il solido viene quindi scaldato – seconda reazione – per dare il carbonato di sodio. L'anidride carbonica che si formava nella seconda reazione e l'ammoniaca della terza erano riciclate nel primo stadio.
Condensazione dell'acido cloridrico
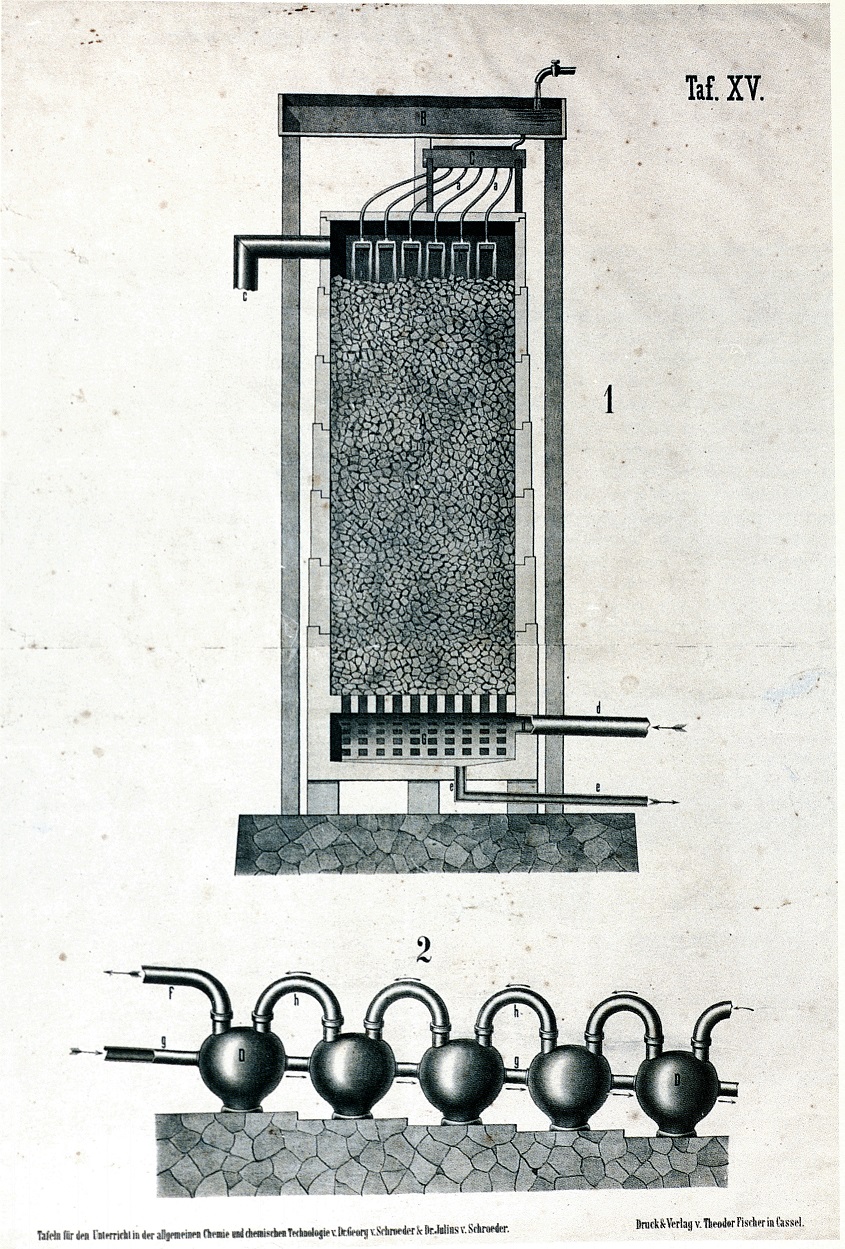
I due impianti illustrati nella tav. XV avevano lo stesso scopo: recuperare l'acido cloridrico proveniente dai forni a riverbero del processo Leblanc.
Nella torre della fig. 1, riempita di coke, i gas acidi erano immessi dalla tubazione (d), ed incontravano l'acqua immessa a pioggia dalla sommità della torre. La soluzione acquosa di acido cloridrico (Hcl) era raccolta dal basso. I gas esausti fuoriuscivano da (c). Nell'impianto 2, i gas acidi gorgogliavano nelle bottiglie di Wuff (D), percorrendo le tubazioni (h) da destra a sinistra. L'acqua immessa in controcorrente dalla tubazione (g) procedeva da sinistra a destra arricchendosi in acido cloridrico. I gas esausti uscivano da (f).
Processi moderni: acido cloridrico
L'acido cloridrico è prodotto attualmente per sintesi diretta dagli elementi: H2 + Cl2 → 2HCl. Si ottiene, allo stato gassoso, un prodotto molto più puro di quello ottenuto per reazione fra cloruro sodico ed acido solforico. L'idrogeno necessario è prodotto per reforming dal metano (o da altri idrocarburi):
CH4 + H2O → 4H2 + CO2
oppure per idroforming:
C + H2O → H2 + CO
CO + H2O → CO2 + H2
Tecnologie antiche: acido nitrico, acido cloridrico, carbonato di sodio
L'acido nitrico, l'acido cloridrico ed il carbonato di sodio sono tre sostanze adatte ad illustrare il ruolo dell'acido solforico nelle tecnologie chimiche dei secoli XVII e XIX. Prima di allora esse si ottenevano per vie diverse da quelle illustrate nelle tavole. L'acido nitrico si otteneva scaldando una miscela di nitrato di potassio e solfato ferroso. Il distillato era usato, già dagli alchimisti, per dissolvere l'argento. Se la miscela scaldata conteneva anche cloruro ammonico il distillato era chiamato acqua regia perché era in grado di dissolvere l'oro: questo distillato conteneva anche acido cloridrico, come ora sappiamo.
Il carbonato di sodio, usato dall'industria tessile come detergente fin dall'antichità, era di origine mineraria. La gamma dei suoi usi è andata aumentando col tempo: industria del vetro, degli smalti, dei saponi. Fu anche preparato per lisciviazione delle ceneri di piante.