Sodio
Preparazione del sodio
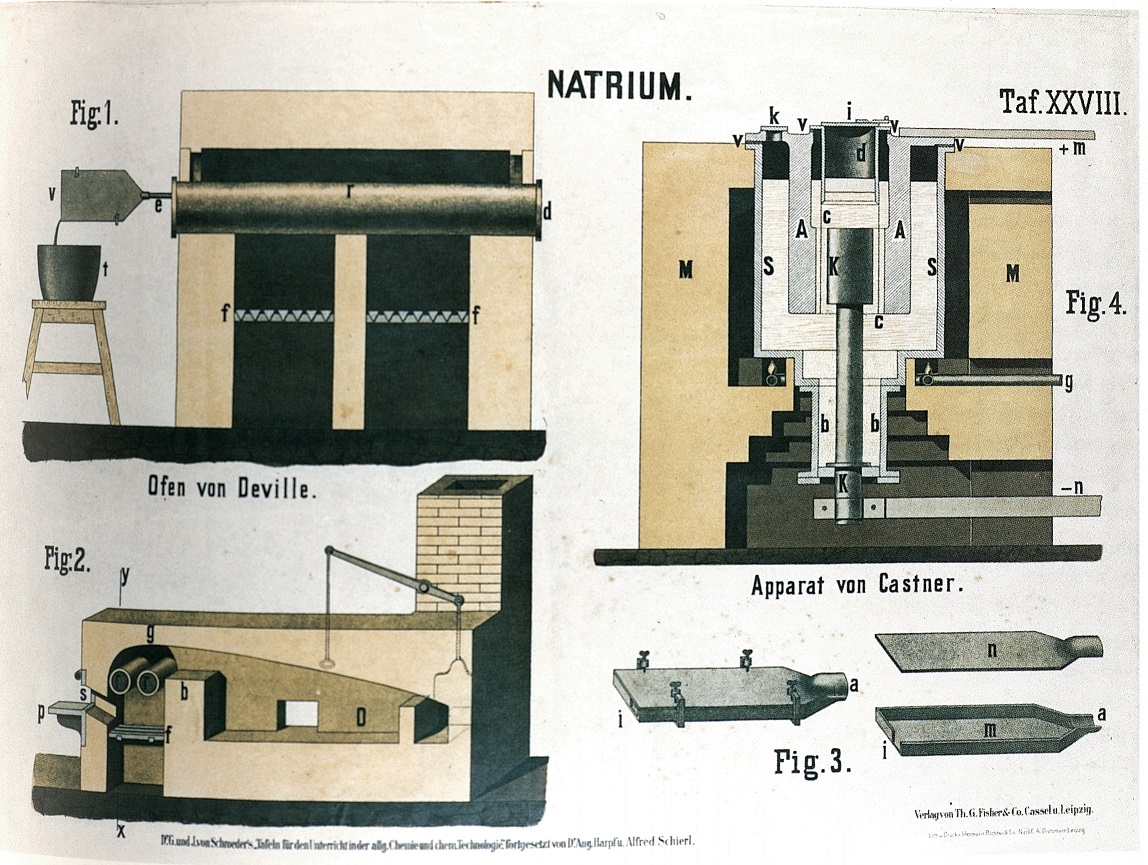
Le figg. 1 e 2 sono due sezioni ortogonali del forno Deville per la preparazione del sodio. La reazione Na2CO3 +2C → 2Na + 3CO avveniva nei tubi (r) scaldati dalla fornace (f). I tubi erano chiusi ed uno dei coperchi portava un tubo (e) terminante con una pala (v) (dettaglio in fig. 3).
Nella pala i vapori di sodio, trasportati dall'ossido di carbonio, condensavano per poi gocciolare nel tino (f) riempito con olio di catrame.
La cella elettrolitica di Castner, fig. 4, per la produzione del sodio a partire dall'idrossido di sodio, era costituita dal crogiolo di ferro (S), in cui la soda era fusa a 330 °C, e dagli elettrodi (K) e (A) negativo e positivo. Il sodio metallico prodotto raggiungeva un serbatoio (d) dove galleggiava sulla soda.
Processi moderni
Il punto debole del processo elettrolitico Castner era il fatto che il materiale di partenza, l'idrossido di sodio, doveva essere prodotto preliminarmente per elettrolisi del cloruro sodico.
Il metodo elettrolitico attuale (metodo Downs) evita questo primo passaggio elettrolizzando direttamente il cloruro di sodio. I vantaggi sono: un materiale di partenza a basso prezzo; manipolazione più facili; una più alta conducibilità dell'elettrolita; un sottoprodotto pregiato (il cloro). Gli svantaggi sono correlati ad un più alto punto di fusione del cloruro di sodio rispetto all'idrossido di sodio. Questo svantaggio viene attenuato elettrolizzando una miscela di cloruro sodico e di cloruro di calcio 60/40. Il processo viene condotto alla temperatura di 560-585 °C in celle cilindriche di ceramica con catodo di ferro che circonda l'anodo di grafite. I due elettrodi sono separati da un diaframma che consente al cloro ed al sodio di raccogliersi separatamente sulla superficie del sale fuso.