Acido solforico
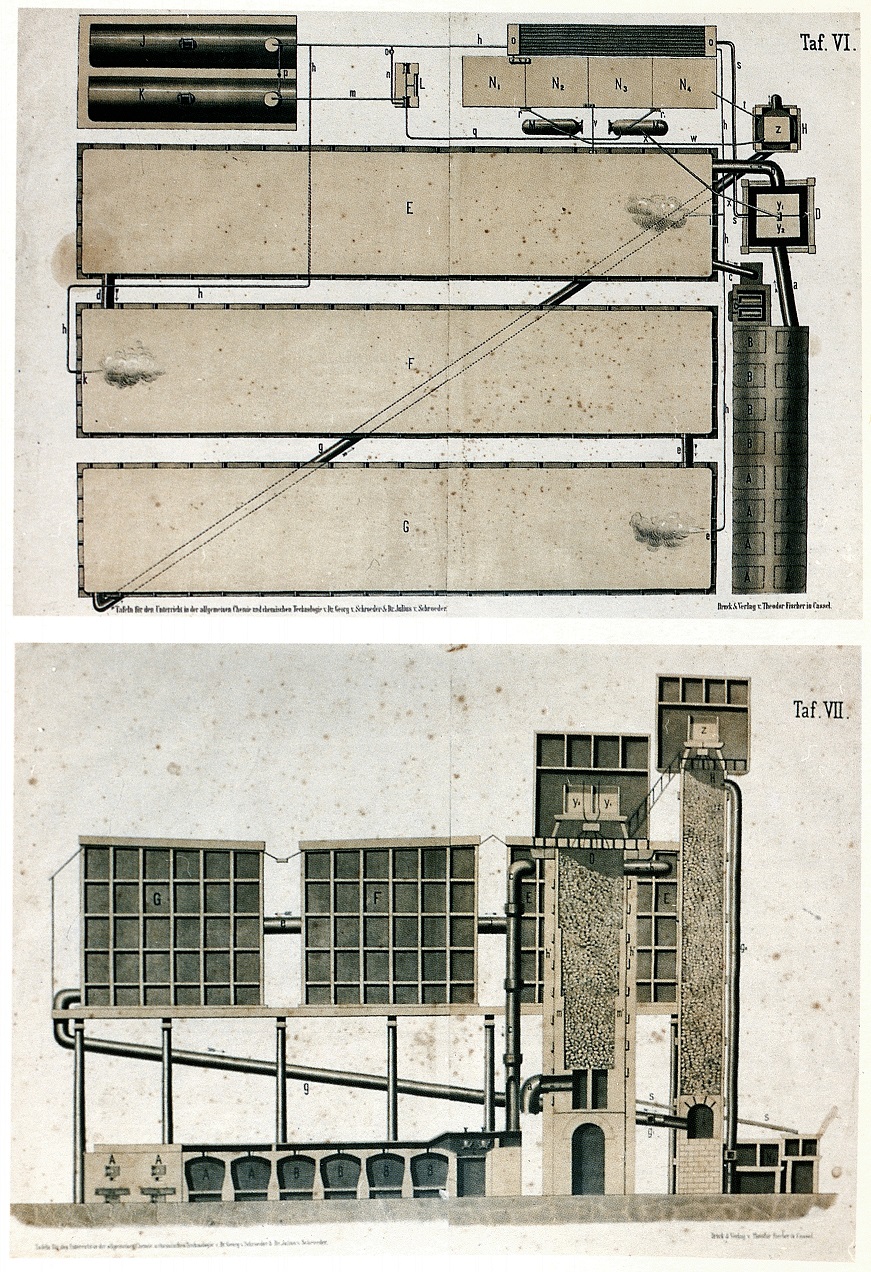
Preparazione dell'acido solforico: camere di piombo
Forni a pirite (A) e (B)
Generatori di vapor d'acqua (J-K)
Pompe (L)
Recipienti di stoccaggio (M-N)
Forni a salnitro (C)
Scambiatori di calore (O)
L'impianto produceva acido solforico in due punti diversi: nella torre di Glover (D) al 78% e nelle camere di piombo (E-F-G) al 65%.
Nella torre di Glower, l'anidride solforosa (SO2) proveniente dai forni a pirite, era ossidata da una miscela di acido nitrico (HNO3) ed acido nitrosil solforico in acido solforico (H2SO4) al 65%, prodotta a sua volta nella torre di Gay-Lussac (H). Nella torre di Glover l'ossidante era introdotto dall'alto in controcorrente all'anidride solforosa. L'eccesso di quest'ultima usciva dalla sommità della torre verso le camere di piombo, dove veniva completata la sua ossidazione. Il ciclo redox era catalizzato da ossido di azoto (NO) ed ipoazotide (NO2) riciclati attraverso la torre di Gay-Lussac. Reattivi consumati erano anidride solforosa, acqua ed ossigeno atmosferico, introdotto nell'impianto attraverso i forni a pirite (A).
Dettagli di una fabbrica di acido solforico
Particolari costruttivi delle camere di piombo: sistemi di distribuzione dell'acido nitrico nelle torri (figg. 1-4), sistemi di pompaggio ad aria compressa (fig. 5)
Concentrazione dell'acido solforico
L'acido solforico prodotto nelle camere di piombo era concentrato al 69% e poteva essere usato in questa concentrazione per la produzione del carbonato di sodio e del perfosfato di calcio. Acido solforico concentrato fino al 78% si otteneva in capsule di piombo riscaldate con vapor d'acqua sotto pressione, circolante in serpentine di piombo (figg. 1-2). Le capsule erano aperte. Altri sistemi (figg. 3-4) usavano apparecchiature chiuse, con le quali si otteneva un acido più puro, più concentrato (fino al 95%) e con minore inquinamento. L'impianto di fig.3 lavorava in continuo usando storte di vetro scaldate ognuna dalla sua fornace. L'acido diluito era fornito alla storta più alta e quello concentrato prelevato, nel recipiente (K), dalla storta più bassa. Il travaso da una storta all'altra era attuato da un sistema di sifoni. L'acqua di evaporazione era raccolta dalla tubazione (D) nella quale erano inserite le teste di tutte le storte. Per produrre acido solforico concentrato esente da impurezze, la concentrazione veniva condotta in alambicchi di platino (fig. 4). Con questi alambicchi si poteva arrivare a produrre fino a 2000 kg di acido al giorno.
Preparazione dell'acido solforico fumante
L'acido solforico fumante era prodotto industrialmente a partire dal vetriolo grezzo (Solfato ferroso FeSO4). Il materiale veniva riscaldato in atmosfera ossidante per dare solfato basico di ferro (FeSO4(OH)) e quindi acido solforico (H2SO4) ed anidride solforosa (SO3) (acido solforico fumante).
4FeSO4 + O2 + 2H2O → 4FeSO4(OH)
2FeSO4(OH) → Fe2O3 + H2SO4 + SO3
La produzione avveniva in forni contenenti più file di recipienti di argilla (a) pieni di vetriolo e scaldati dalla fornace.
L'acido solforico e l'anidride solforica distillavano in recipienti (c) contenenti acido solforico diluito. Per ottenere acido solforico concentrato era necessario eseguire 3 o 4 cotture di vetriolo.
Processi moderni
Tutto l'acido solforico attualmente in commercio è preparato con questo metodo. Il materiale di partenza è ancora l'anidride solforosa proveniente dagli impianti di arrostimento delle piriti ( o da quelli di combustione dello zolfo). Essa è mescolata con aria ed inviata al reattore catalitico. Il catalizzatore è asbeto platinato o pentossido di vanadio. Sul catalizzatore avviene la reazione
2SO2 + O2 → 2SO3
L'anidride solforica che si forma viene fatta assorbire da acido solforico. Si ottiene acido solforico concentrato (Oleum), dal quale poi, per diluizione si ottiene acido di qualsivoglia concentrazione. Le operazioni chimiche di questo processo avvengono tutte in fase gassosa, e questo elimina tutte le complicazioni descritte nelle tavole 6-10.
Tecnologie antiche: fabbricazione dell'acido solforico
Le prime ricette per la preparazione dell'acido solforico sono del XVI secolo. Lo si otteneva per arrostimento del solfato ferroso. Nel XVII secolo divenne un reattivo importante per la preparazione industriale del carbonato di sodio e si pose il problema di ottenerlo in modo più economico ed a scala maggiore. Nel 1749 J.Ward lo preparò con un metodo migliore scaldando una miscela di zolfo e nitrato di potassio con poca acqua e distillando quindi la miscela di reazione. Un inconveniente di questo metodo era la fragilità delle apparecchiature di vetro. Pochi anni dopo J: Roebuck mise a punto il processo delle camere di piombo.