Processi elettrochimici
Preparazione del sodio
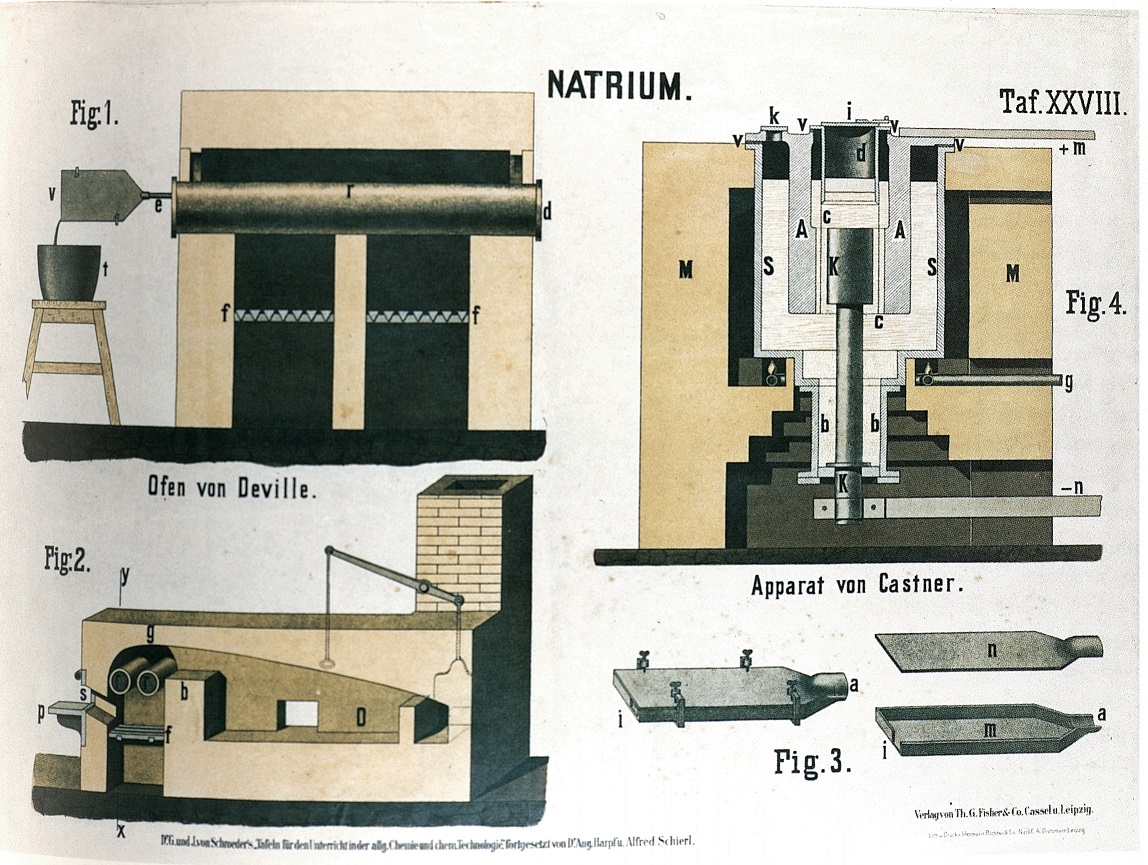
Le figg. 1 e 2 sono due sezioni ortogonali del forno Deville per la preparazione del sodio. La reazione Na2CO3 +2C → 2Na + 3CO avveniva nei tubi (r) scaldati dalla fornace (f). I tubi erano chiusi ed uno dei coperchi portava un tubo (e) terminante con una pala (v) (dettaglio in fig. 3).
Nella pala i vapori di sodio, trasportati dall'ossido di carbonio, condensavano per poi gocciolare nel tino (f) riempito con olio di catrame.
La cella elettrolitica di Castner, fig. 4, per la produzione del sodio a partire dall'idrossido di sodio, era costituita dal crogiolo di ferro (S), in cui la soda era fusa a 330 °C, e dagli elettrodi (K) e (A) negativo e positivo. Il sodio metallico prodotto raggiungeva un serbatoio (d) dove galleggiava sulla soda.
Processi moderni: sodio
Il punto debole del processo elettrolitico Castner era il fatto che il materiale di partenza, l'idrossido di sodio, doveva essere prodotto preliminarmente per elettrolisi del cloruro sodico.
Il metodo elettrolitico attuale (metodo Downs) evita questo primo passaggio elettrolizzando direttamente il cloruro di sodio. I vantaggi sono: un materiale di partenza a basso prezzo; manipolazione più facili; una più alta conducibilità dell'elettrolita; un sottoprodotto pregiato (il cloro). Gli svantaggi sono correlati ad un più alto punto di fusione del cloruro di sodio rispetto all'idrossido di sodio. Questo svantaggio viene attenuato elettrolizzando una miscela di cloruro sodico e di cloruro di calcio 60/40. Il processo viene condotto alla temperatura di 560-585 °C in celle cilindriche di ceramica con catodo di ferro che circonda l'anodo di grafite. I due elettrodi sono separati da un diaframma che consente al cloro ed al sodio di raccogliersi separatamente sulla superficie del sale fuso.
Preparazione elettrolitica dell'alluminio
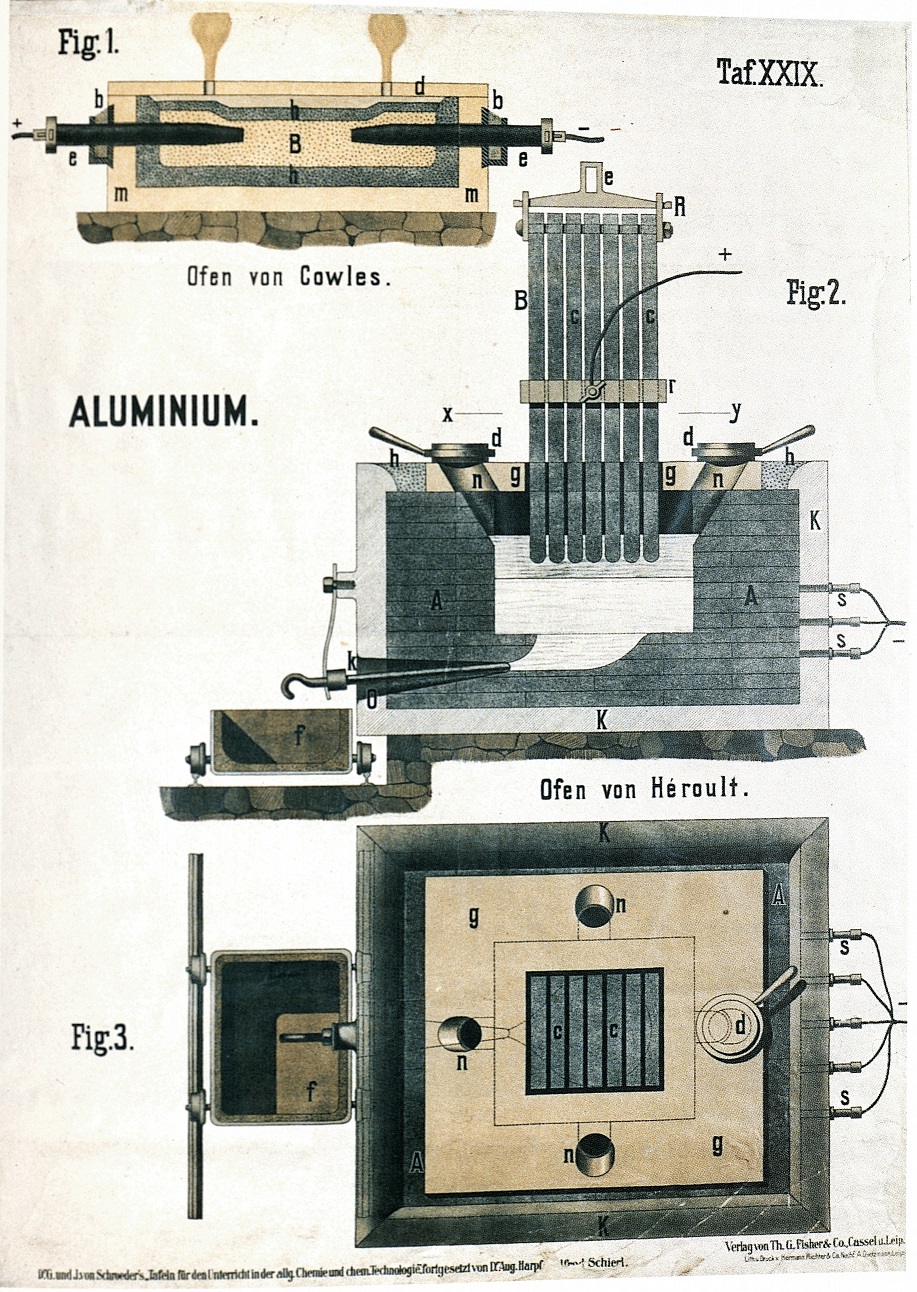
Il processo Cowles usava la cella di fig.1. In essa avveniva la reazione Al2O3 + 3C → 2Al + 3CO.
Era un processo elettrotermico: il passaggio di corrente elettrica aveva soltanto lo scopo di raggiungere le temperature elevate necessarie per la reazione. La carica della cella era una miscela di ossido di alluminio, rame e carbonio. L'alluminio era ottenuto sotto forma di lega con il rame (bronzo di alluminio).
Il processo Heroult (tuttora in uso) è invece un processo elettrochimico vero e proprio. La cella vista in sezione in fig. 2 ed in pianta in fig. 3 è una vasca di ferro (K), internamente rivestita di carbone compresso in blocchi (A), che hanno la funzione di catodo.
L'anodo è formato da un fascio di aste di carbone (B). Il bagno elettrolitico è costituito da una miscela di allumina sciolta in criolite (Na3AlF6).
Il primo passaggio di corrente serve per portare a fusione la criolite. Ha quindi inizio il processo elettrolitico con formazione di alluminio al catodo ed ossigeno all'anodo. Quest'ultimo, reagendo con l'ossigeno si consuma durante l'elettrolisi. L'alluminio fuso è prelevato dal fondo della vasca.
Processi moderni: alluminio
L'alluminio si prepara tuttora con il processo elettrolitico. Il maggiore inconveniente delle celle di Heroult era l'elevato consumo degli anodi da parte dell'ossigeno prodotto nel processo.
Attualmente è preferito l'anodo molto più economico di Soderberg, costituito da un impasto di catrame coke e petrolio nel quale vengono inseriti i conduttori di corrente.
Fosforo e carburo di calcio
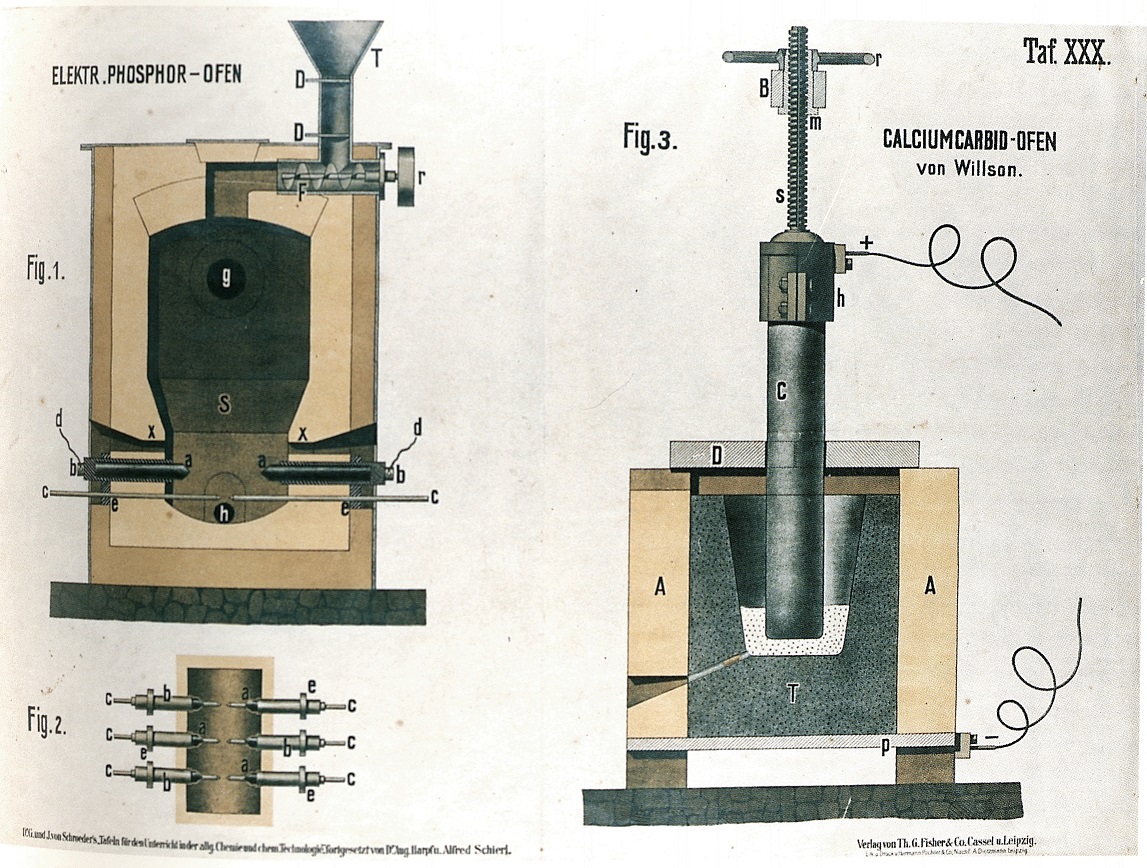
L'impianto funzionava in continuo rifornito dalla miscela di partenza attraverso la tramoggia (T) e la coclea (F). Il fosforo distillava dall'apertura (g) a 1150 °C. Dall'apertura (h) venivano prelevate le scorie costituite soprattutto da carburo di calcio, CaC2. La fig. 2 mostra un dettaglio in pianta degli elettrodi (b).
Il carburo di calcio era preparato nel forno elettrico di Wilson, fig. 3, a partire da una miscela di ossido di calcio e catrame (attualmente si usa carbonio): la reazione 2CaO + 6C → 2CO + 2CaC2 decorre alla temperatura dell'arco elettrico, che scocca fra il crogiolo (F) e l'elettrodo (C), entrambi di grafite.
Processi moderni: fosforo
Il fosforo bianco si prepara tuttora in fornaci elettriche. Gli impianti moderni usano corrente trifase e gli elettrodi di carbone sono disposti verticalmente ai vertici di un triangolo equilatero a breve distanza dal fondo della fornace, anch'esso di carbone. Particolare cura è dedicata alla granulazione del materiale di partenza: il fosfato tricalcico, la silice ed il carbone. Essi devono avere la stessa granulazione e devono essere distribuiti in modo omogeneo, così da avere la stessa permeabilità ai gas prodotti (CO e fosforo) in tutta la massa di reazione. Qualsiasi disomogeneità provoca infatti disomogeneo consumo degli elettrodi, differenze di resistenza elettrica e di temperatura nella massa di reazione, intasamenti ed aumenti di pressione.
Inconvenienti che si traducono in aumenti dei costi di manutenzione.
Fosforo rosso: il principale inconveniente dell'impianto ottocentesco illustrato nella tavola 19 era il fatto che il fosforo rosso si otteneva sotto forma di una massa dura e compatta che poneva problemi anche per lo svuotamento del reattore. I processi moderni usano reattori cilindrici, rotanti sull'asse cavo orizzontale, al cui interno piccole sfere di acciaio frantumano la massa di reazione. Il fosforo rosso è ottenuto così in forma polverosa.